

Trong bài viết dưới đây, Trường kinh doanh công nghệ sẽ chia sẻ tới bạn những kiến thức liên quan đến phương trình Al HNO3 Đặc Nóng. Mời bạn đọc cùng theo dõi!
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
Điều kiện để Al tác dụng với HNO3 ra NO2: HNO3 đặc, nóng.
Cách tiến hành thí nghiệm của phản ứng Al tác dụng với HNO3 :Cho mảnh nhôm vào ống nghiệm đã đựng sẵn HNO3, đun nóng.
Hiện tượng phản ứng của phản ứng Al tác dụng với HNO3 : Nhôm (Al) tan dần trong dung dịch axit HNO3, xuất hiện khí nitơ đioxit (NO2) có màu nâu đỏ.
Cách lập phương trình hoá học của phản ứng Al tác dụng với HNO3
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
0Al+H+5NO3→+3Al(NO3)3++4NO2+H2O
Chất khử: Al; chất oxi hoá: HNO3.
Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
– Quá trình oxi hoá: 0Al→+3Al+ 3e
– Quá trình khử: +5N+ 1e→+4N
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
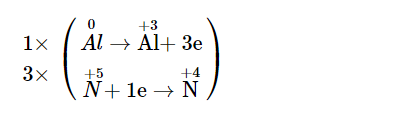
Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
Trên đây là những thông tin liên quan về phương trình Al HNO3 Đặc Nóng Truongkinhdoanhcongnghe hi vọng bài viết này hữu ích với bạn. Chúc bạn học tập tốt!
Xem thêm: