Hóa Học
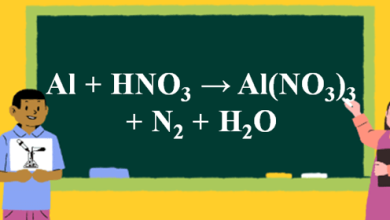
Phương Trình Phản Ứng Al HNO3 Al NO3 3 N2 N2O H2O
Al HNO3 Al NO3 3 N2 N2O H2O được Trường kinh doanh công nghệ biên soạn là phản ứng oxi hóa khử khi cho Al tác dụng với dung dịch HNO3 loãng sau phản ứng thu được muối nhôm và khí nito. Mời bạn cùng theo dõi và tìm hiểu chi tiết về phương trình này qua bài viết sau.

Chi Tiết Phương trình Al HNO3 Al NO3 3 N2 N2O H2O
Điều kiện để phản ứng xảy ra :Nhiệt độ thường
Hướng dẫn cân bằng phản ứng: Xác định sự thay đổi số oxi hóa
Al0 + HN+5O3 → Al+3(NO3)3 + N02+ N+12O + H2O
| Quá trình oxi hóa: 28x Quá trình khử: 3x | Al0 → Al+3 + 3e N+5 +28e → N2+1 + 2N20 |
Đặt hệ số thích hợp ta được phương trình phản ứng:
- 28Al + 102HNO3 → 28Al(NO3)3 + 6N2 + 3N2O + 51H2O
Như vậy bài viết trên đây Truongkinhdoanhcongnghe đã cung cấp đến bạn đọc những kiến thức về Phương Trình Phản Ứng Al HNO3 Al NO3 3 N2 N2O H2O. Chúc bạn học tập tốt!
Xem thêm: