

Trong bài viết dưới đây Trường kinh doanh công nghệ sẽ hướng dẫn bạn lập Sơ Đồ Tư Duy Về Nguyên Tử ngắn gọn và dễ hiểu nhất. Mời bạn đọc cùng theo dõi!
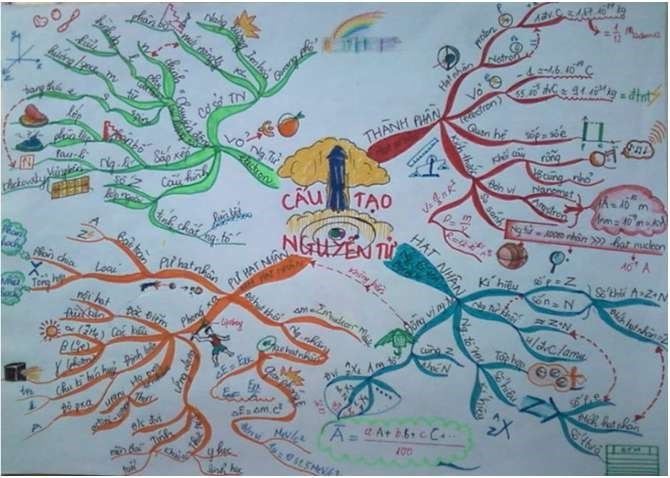
Mẫu 1
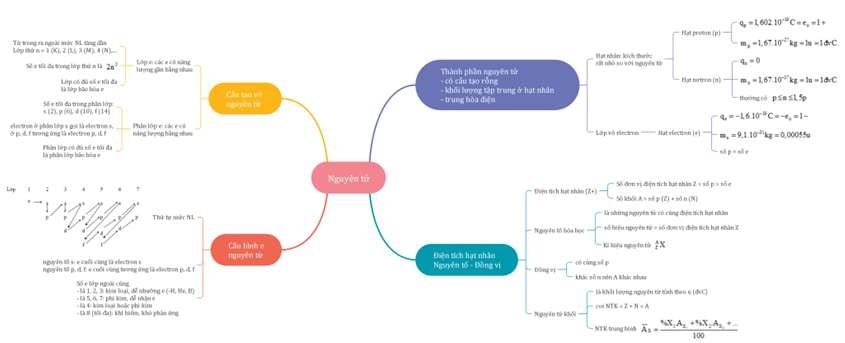
Mẫu 2
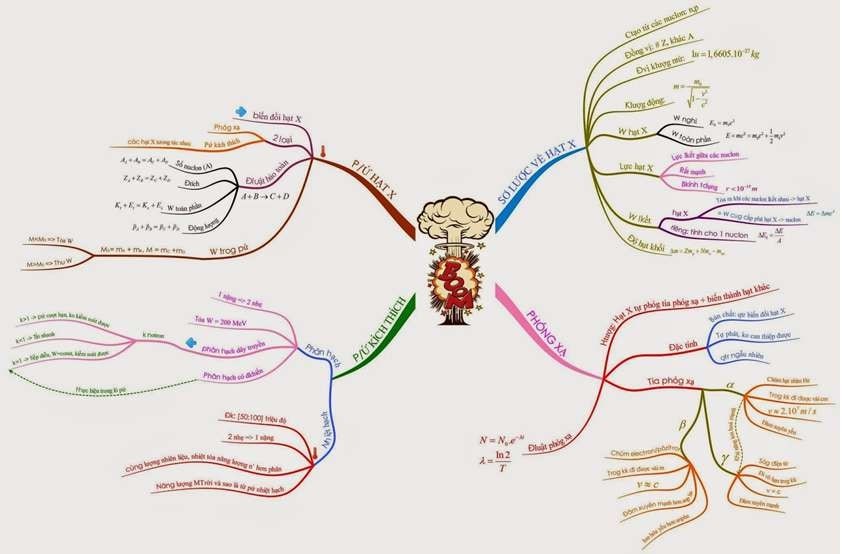
Mẫu 3
Trên đây là những thông tin và kiến thức liên quan đến lập Sơ Đồ Tư Duy Về Nguyên Tử mà Truongkinhdoanhcongnghe tổng hợp được. Hi vọng bài viết hữu ích với bạn.
Xem thêm: