

Trong bài viết dưới đây mời bạn cùng Trường kinh doanh công nghệ theo dõi và tìm hiểu về PTHH Al HNO3 Al NO3 3 NH4NO3 H2O.

8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3+ 9H2O
Sử dụng phương pháp thăng bằng electron cân bằng phản ứng oxi hóa khử Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O. Cụ thể:
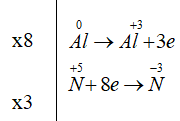
Điền hệ số 8 vào Al, Al+3; điền hệ số 3 vào N-3
Vậy phương trình phản ứng: 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Điều kiện Al tác dụng với HNO3 : Nhiệt độ phòng

Nhôm (bắt nguồn từ tiếng Pháp: aluminium, phiên âm tiếng Việt là: a-luy-mi-nhôm) là 1 nguyên tố hóa học có trong bảng tuần hoàn nguyên tố có ký hiệu Al, có số nguyên tử bằng 13.
Nhôm là kim loại có màu trắng bạc, khá mềm, rất nhẹ và có thể dẫn được điện, nhiệt tốt. Nhôm không độc và có chúng khả năng chống mài mòn rất tốt.
So với các kim loại khác thì nhôm được sử dụng nhiều trong đời sống và trong các ngành công nghiệp phổ biến, đặc biệt là trong công nghiệp sản xuất ô tô.
Kim loại Nhôm có độ phản chiếu cao cũng như có đặc tính dẫn nhiệt và dẫn điện lớn. Nhôm là kim loại không độc hại và có tính chống mài mòn. Nhôm cũng là kim loại có rất nhiều thành phần trong đó.
Những tính chất hóa học cơ bản của nhôm chính xác dưới đây sẽ giúp chúng ta hiểu rõ hơn về kim loại nhôm phản ứng được với hợp chất nào và trong nhôm có những hợp chất nào nhé.
Nhôm – Al có thể đẩy được kim loại đứng sau trong dãy hoạt động kim loại được tách ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 => Al2(SO4)3 + 3Cu
Trên thực tế thì tất cả các vật liệu được làm từ kim loại nhôm cũng đều có 1 lớp oxit bảo vệ trên toàn bộ bề mặt. Kim loại Nhôm phản ứng được với oxi trên cả bề mặt của chúng. Vì khi xảy ra phản ứng hóa học này, kim loại nhôm sẽ tạo ra 1 lớp màng oxit bao phủ bề mặt.
Qua đó chúng sẽ được bảo vệ và ngăn cản nhôm tác dụng với oxi để sau đó tạo ra oxit:
2Al + 3O2 => Al2O3
Al2O3 là 1 oxit lưỡng tính, vì thế tính chất hóa học của nhôm ôxít Al2O3 sẽ thuộc dạng một oxit lưỡng tính. Tức là chúng có thể phản ứng với cả bazơ và axit.
Bên cạnh đó, kim loại nhôm còn phản ứng được với các loại phi kim khác để tạo ra muối.
Ví dụ:
Trên thực tế, nhôm sẽ không phản ứng được với nước (H2O) vì chúng được bảo vệ bởi lớp oxit mỏng. Khi lớp oxit này được phá bỏ, nguyên tố nhôm sẽ phản ứng trực tiếp với nước.
2Al + 6H2O => 2Al(OH)3 và 3H2
Với những loại axit khác nhau, kim loại nhôm sẽ có phản ứng khác nhau.
Cụ thể:
Nhôm Al có thể dễ dàng tham gia những phản ứng với các dung dịch kiềm như:
Al + NaOH + H2O tạo ra NaAlO2 + 1,5 H2
Trước tiên, Nhôm tham gia phản ứng với nước sau đó sẽ sinh ra Al( OH )3. Và đây là một hidroxit lưỡng tính chúng có thể tan được trong dung dịch kiềm.

Phản ứng nhiệt nhôm chính là phản ứng hóa học toả nhiệt trong đó kim loại nhôm là chất khử ở nhiệt độ cao. Ví dụ chúng nổi bật nhất là phản ứng nhiệt nhôm giữa nguyên tố oxit sắt III và nhôm:
Một số phản ứng hóa học khác như:
Phản ứng này sẽ được sử dụng để khử oxit kim loại mà không sử dụng cacbon. Phản ứng này sẽ toả nhiệt rất cao, nhưng nó có một dạng ăng lượng hoạt hóa cao do các liên kết giữa các nguyên tử trong chất kim loại rắn phải được phá vỡ trước.
Oxit kim loại sẽ được đun nóng với nhôm trong một lò đun. Phản ứng này sẽ chỉ có thể sử dụng để sản xuất số lượng nhỏ vật liệu.
Phản ứng nhiệt nhôm còn được sử dụng dùng để điều chế các kim loại có nhiệt độ nóng chảy cao ( như crôm hay Von farm ). Do chúng có tính chất thụ động với HNO3 đặc nguội và H2SO4 đặc nguội, người ta sẽ sử dụng thùng nhôm để có thể chuyên chở hai loại axit này.
Người ta thường sử dụng tất cả các phản ứng này để hàn đường sắt tại chỗ, dùng khá tốt cho việc cài đặt phức tạp hoặc sửa chữa tại chỗ và không thể được thực hiện bằng cách sử dụng cách hàn đường sắt liên.
Phản ứng nhiệt nhôm cũng thường được sử dụng để sản xuất phần lớn hợp kim sắt, ví dụ như ferrovanadium từ Vanadi oxit và ferroniobium từ niobium pentoxit. Các kim loại khác cũng sẽ được sản xuất bằng phương pháp này.

Trong tự nhiên rất khó để tìm được nguồn khoáng sản nhôm nguyên chất, thông thường kim loại này được tìm thấy khi đã được kết hợp cùng oxygen cùng với những nguyên tố khác. Người ta vẫn thường gọi chúng là hợp kim nhôm.
Để điều chế nhôm thường chỉ dùng phương pháp điện phân nóng chảy. Do trong tự nhiên nhôm tồn tại chủ yếu ở dạng nhôm oxit nên điện phân nóng chảy nhôm oxit là cách hiệu quả nhất:
Nguyên liệu: Quặng boxit Al2O3 (thường bị lẫn SiO2 và Fe2O3).
Các giai đoạn điều chế:
Bước 1: Tinh chế quặng boxit (làm sạch nguyên liệu):
Đây là giai đoạn quan trọng vì nếu không làm sạch nguyên liệu nhôm điều chế ra có lẫn tạp chất sẽ dễ bị ăn mòn hóa học và ăn mòn điện hóa.
Nguyên liệu được cho tác dụng với dung dịch xút nóng:
Sau đó sục khí CO2 dư vào dung dịch:
Lọc lấy kết tủa nung ở 9000C sẽ thu được oxit nhôm tinh khiết:
Bước 2: Điện phân Al2O3 nóng chảy:

Điện phân nóng chảy Al2O3 có mặt criolit Na3AlF6 (giúp hạ nhiệt độ nóng chảy của Al2O3từ 20500C xuống 9000C; tăng độ dẫn điện do tạo thành nhiều ion hơn; tạo lớp bảo vệ không cho O2 phản ứng với Al nóng chảy):
Quá trình điện phân thường dùng điện cực bằng than chì nên có phản ứng phụ giữa điện cực và oxi ở cực dương (tạo khí CO và CO2) vì vậy trong quá trình điện phân phải thường xuyên hạ thấp điện cực.
Như vậy bài viết trên đây Truongkinhdoanhcongnghe đã cung cấp đến bạn đọc những kiến thức về Phương Trình Phản Ứng Al HNO3 Al NO3 3 NH4NO3 H2O. Chúc bạn học tập tốt!
Xem thêm: